ПЕРЕКИСНЫЕ СОЕДИНЕНИЯ
, класс хим.
Соответственно по наличию этих групп различают
Пергидроксил - промежуточная частица большинства
К этим группам соединений примыкают пероксигидраты
Пи ероксогруппа - О - О - входит в состав
П. с. нашли применение в технике как окислители
А. П. Пурмаль.
Перекисные соединения органические содержат
П. с. получают гл. обр. окислением различных
Перекиси ацилов и надкислоты получаются
Перекись диметила СН При нагревании или облучении ультрафиолетовым
Образующиеся свободные радикалы могут вызвать
Органич. П. с. (перекиси бензоила, ацетила,
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
соединений, содержащих непосредственно связанные между собой атомы кислорода.
Перекисные соединения неорганические. Простейший, наиболее важный и распространённый
представитель этой группы - перекись водорода Н
анионов кислорода
![]()
перекиси, надперекиси и озониды. Все они являются различной силы окислителями,
а при слабых термич. или химич. воздействиях разлагаются с выделением кислорода.
Наиболее просто - сжиганием на воздухе или в кислороде - получают перекиси
и надперекиси щелочных металлов: Na
водорода Н
в Н
химич. процессов горения и окисления кислородом и перекисью водорода. Действием
озона
(О
Гидролиз этих П. с. происходит с образованием различных по силе окислителей
(насыщенных соединений, как Н
- соединения, содержащие вместо кристаллизационной воды кристаллизационную
Н
пероксо- или надкислот и двуядерных комплексных соединений. Примером служат
пероксосерные кислоты - пероксомоно- и пероксодисерная, HOSO
либо путём электролиза обычных кислот, либо при взаимодействии концентрированных
кислот и Н
мн. из них могут быть получены при взаимодействии кислорода с солями кобальта
(в растворе или в кристаллич. состоянии). Большинство пероксосоединений
водой гидролизуется с образованием Н
(пероксодисерная кислота, перекись натрия), отбеливатели (пероксобораты,
напр. NаВОз; пероксокарбонаты, напр. Na
СО
или изменении кислотности раствора выделяют кислород. На этом основано
их применение как "кислородных батарей", как переносчиков кислорода, для
разделения азотно-кислородных смесей. Различие в строении неорганич. П.
с. обусловливает различие их физич. свойств и реакционной способности и
возможность применения в разнообразных условиях.
группировку - О - О -, связанную с одним или двумя атомами углерода. Осн.
типы органич. П. с.: 1) перекиси алкилов и арилов R - О - О - R (здесь
и далее R-алкил или арил); 2) перекиси ацилов RCO - О - О - COR; 3) гидроперекиси
R - О - О - Н; 4) перкислоты (надкислоты) RCO - О - О - Н. К ним примыкают
соединения, в к-рых перекисная группировка связана с гетероатомом, напр.
R
органич. соединений (напр., насыщенных углеводородов, олефинов, спиртов,
альдегидов, кетонов, металло-органич. соединений) кислородом (часто - фотохимически)
или перекисью водорода, напр.:

взаимодействием карбоновых к-т или их производных с перекисью водорода
в присутствии оснований:
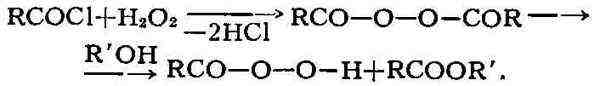
рт. ст.); перекись бензоила (C
с. типа
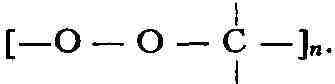
светом органич. П. с. происходит разрыв кислород-кислородной связи с образованием
свободных радикалов типа RO · или RCO - О·, дальнейшая судьба к-рых (а
следовательно, и общее направление реакции) зависит от характера R. Алкоксильные
или ацилоксильные радикалы чаще всего распадаются дальше, давая свободные
углеводородные радикалы, напр.:
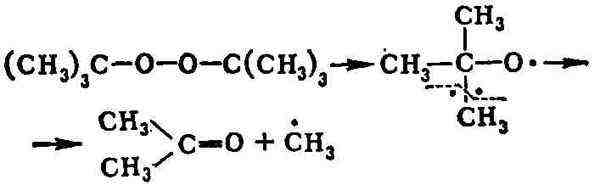
цепной распад П. с., поэтому многие из них, особенно низшие, взрывчаты.
Это необходимо учитывать при работе с олефинами, диенами и простыми эфирами,
легко образующими П. с. при действии кислорода воздуха. Стабильность П.
с. возрастает с увеличением электроотрицательности заместителей, связанных
с перекисной группой, а также при переходе от первичных радикалов к вторичным
и третичным.
ди-трет-бутила) широко используют для инициирования свободнорадикальной
полимеризации,
вулканизации каучуков, а также таких реакций, как окисление, галогенирование,
присоединение по двойным связям, теломеризация и др. П. с., особенно надкислоты,
применяются в органич. синтезе как окислители, напр. для получения окисей
олефинов (Прилежаева реакция), в текст. пром-сти - как отбеливающие
вещества. П. с.- промежуточные продукты многих промышленно важных реакций,
напр. синтеза фенола и ацетона окислением
кумола', они
играют большую роль в процессах горения и окислительных биохимич. процессах.
Б.
Л. Дяткин. Лит.: Вольнов И. И., Перекиси, надперекиси и озониды щелочных
и щелочноземельных металлов, М., 1964; его же, Современные воззрения на
природу неорганических перекисных соединении, "Успехи химии", 1972. т.
41, в. 4; Карножицкий В., Органические перекиси, пер. с франц., М., 1961.