РАДИКАЛЫ СВОБОДНЫЕ
кинетически
независимые частицы, характеризующиеся наличием неспаренных электронов.
Напр., к неорганич. Р. с., имеющим на внешнем уровне один электрон (см.
Атом,
Валентность), относятся атомы водорода Н•, щелочных металлов (Na•,
К• и др.) и галогенов (С1•, Br•, F•, I•), молекулы окиси •NO и двуокиси
•NO2 азота (точка означает неспаренный электрон). Наиболее широко распространены
Р. с. в органич. химии. Их подразделяют
на короткоживущие и долгоживущие. Короткоживущие
СН = СН СН (б)
СН = СН С. Хиншелвуд и Н. Н. Семёнов
Значительное число Р. с. принадлежит к
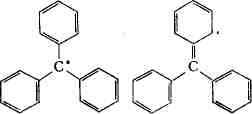
Первый стабильный Р. с. - трифенилметил
Известно большое число триарилметильных
При окислении или восстановлении нейтральных
Самостоятельную группу анион-радикалов
Р. с., содержащие два не взаимодействующих
К неорганич. бирадикалам относится молекула
Р. с. исследуются различными физико-химич.
Короткоживущие Р. с.- промежуточные частицы
Лит.: УоллингЧ., Свободные радикалы
Н. Т. Иоффе.
В биологических системах мн. биохимич.
В организме Р. с. могут генерироваться
Лит.: Козлов Ю. П., Свободноради-кальные
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
алкильные (R•) и арильные (Аr• ) Р. с. со временем жизни менее 0,1 сек
образуются
при гомолитич. расщеплении различных хим. связей. Впервые алкильные Р.
с. метил (СН
в газовой фазе. Для короткоживущих Р. с. характерны реакции рекомбинации
(а), присоединения (б) и диспропорционирования (в), протекающие с очень
высокими скоростями:
показали
важную роль короткоживущих Р. с. в цепных реакциях, механизм к-рых
включает перечисленные выше типы реакций.
долгоживущим, или стабильным. В зависимости от условий (напр., наличие
или отсутствие влаги и кислорода воздуха) продолжительность жизни их составляет
от нескольких минут до нескольких месяцев и даже лет. Более высокая устойчивость
этих Р. с. обусловлена следующими основными причинами: 1) частичной потерей
активности неспаренного электрона в результате взаимодействия его со мн.
атомами молекулы (т. н. делокализация неспаренного электрона); 2) малой
доступностью атома, несущего неспаренный электрон, вследствие экранирования
его соседними атомами (см. Пространственные затруднения).
(С
радикала связана с делокали-зацией неспаренного электрона по всем атомам,
что формально можно объяснить резонансом между возможными электронными
структурами (см. Резонанса теория, Квантовая химия):
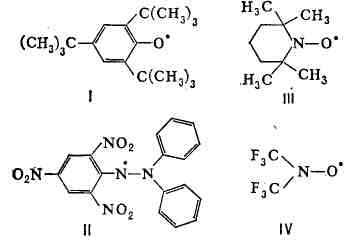
Р. с. К Р. с., стабильным благодаря пространственным явлениям, относятся
продукты окисления замещённых фенолов, т. н. феноксильные Р. с., напр.
три-трет-бутилфеноксил (I). Др. примеры долгоживущих Р. с.-дифенилпикрилгидразил
(II), а также иминоксильные Р. с., напр, тетраметилпиперидиноксил (III)
и бмс-трифторметилнитроксил (IV):
молекул образуются заряженные Р. с.- катион-радикалы (напр., при окислении
ароматич. углеводородов кислородом) или анион-радикалы (при восстановлении
ароматич. углеводородов щелочными металлами):
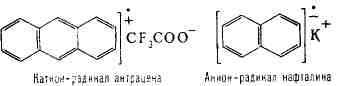
представляют открытые (1932) нем. химиком Л. Михаэлисом продукты одно-электронного
восстановления хинонов - семихиноны, напр, бепзосемихинон:

друг с другом неспаренных электрона, наз. бирадикалами; примером может
служить углеводород Шлёнка:
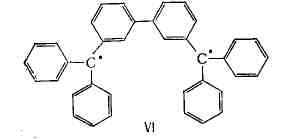
кислорода. Существуют также полирадикалы, содержащие более двух неспаренных
электронов.
методами (электроннаяспектроскопия, масс-спектроскопия, электрохимич. методы,
метод ядерного магнитного резонанса). Наиболее эффективен метод электронного
парамагнитного резонанса (ЭПР), к-рым можно исследовать и ко-роткоживущие
Р. с. ЭПР даёт уникальную информацию о физ. природе неспаренного электрона
и характере его поведения в молекуле; эти данные весьма ценны для квантовохимич.
расчётов.
во многих органич. реакциях (радикальное галогенирование, сульфо-хлорирование,
металлирование, реакции Виттига, Кольбе, Коновалова, разложение органич.
перекисей и др.), а также в реакциях, протекающих под действием ионизирующих
излучений. Долгоживу-щие Р. с. используются как стабилизаторы для легко
окисляющихся соединений, как "ловушки" для короткоживущих радикалов, а
также в ряде кинетич. исследований. Изучение катион-радикалов и анион-радикалов
даёт ценную информацию о характере взаимодействия ионов в растворе. Р.
с. играют большую роль в окислительно-восстановительных, фотохимических
и каталитических процессах, а также в важнейших пром. процессах: полимеризации,
теломеризации, пиролиза, крекинга, горения, взрыва, гетерогенного катализа.
в растпоре, пер. с англ., М., 1960; Семёнов Н. Н., О некоторых проблемах
химической кинетики и реакционной способности, 2 изд., М., 1958; Бучаченко
А. Л., В а с с е р м а н А. М., Стабильные радикалы. Электронное строение,
реакционная способность и применение, М., 1973.
реакции протекают с участием Р. с. в качестве активных промежуточных продуктов.
Методом ЭПР показано, что все активно метабо-лизирующие клетки растений
и животных содержат Р. с. в концентрации К)-6 -108молей
на
1 г ткани. Особенно значительна роль Р. с. в реакциях окисления биологического,
где
они участвуют в образовании переносчиков электронов типа хинонов и флавинов,
входящих в мембранные структуры. Р. с. возникают также при перекисном окислении
липидов в биологических мембранах.
и при действии на него различных физ. и хим. факторов. В частности, влияние
радиации на организмы связывают с образованием Р. с. как при радиолизе
воды, содержащейся в клетках (радикалы 'ОН, НО'2), так и при воздействии
излучений на молекулы органич. в-в и биополимеров клетки (см. Биологическое
действие ионизирующих излучений, Кислородный эффект). Иминоксиль-ные
Р. с. широко применяют в биохимич. исследованиях для выяснения конфигурации
белковых молекул (метод спиновой метки и метод парамагнитного зонда) и
функциональных свойств биологич. мембран.
процессы в биологических системах, в кн.: Биофизика, М., 1968; Ингрэм Д.,
Электронный парамагнитный резонанс в биологии, пер.с англ., М., 1972. Ю.
Я. Козлов.