СЕРА
(лат. Sulfur)
Историч. справка. С. в самородном
Распространение в природ
Ф и з и ч. и химич. свойства.
При плавлении С. превращается
Если расплавленную С., нагретую
С.- плохой проводник тепла
Конфигурация внешних электронов
С. химически активна и особенно
При нагревании С. взаимодействует
Получение. Элементарную С.
Na NaHAsS 2) H В основе получения С. из
В 1972 элементарной С. в
Сорта С. Выплавленная непосредственно
Сконденсированная из паров
Применение. С. применяется
В мед. практике применение
Сера в организме. В виде
Неорганич. соединения С.
В клетках сульфаты, взаимодействуя
Катализирующий эту реакцию
Животные усваивают С. в составе
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
S, химич. элемент VI группы периодич. системы Менделеева; ат. н. 16, ат.
м. 32,06. Природная С. состоит из четырёх стабильных изотопов: 32S
(95,02%), 33S (0,75%), 34S (4,21%), 36S(0,02%).
Получены также искусств. радиоактивные изотопы 31S (T
373(Т
состоянии, а также в виде сернистых соединений известна с древнейших времён.
Она упоминается в Библии, поэмах Гомера и др. С. входила в состав
"священных" курений при религ. обрядах; считалось, что запах горящей С.
отгоняет злых духов. С. давно стала необходимым компонентом зажигат. смесей
для воен. целей, напр. "греческого огня" (10 в. н. э.). Ок. 8 в. в Китае
стали использовать С. в пиротехнич. целях. Издавна С. и её соединениями
лечили кожные заболевания. В период арабской алхимии возникла гипотеза,
согласно к-рой С. (начало горючести) и ртуть (начало металличности) считали
составными частями всех металлов. Элементарную природу С. установил А.
Л. Лавуазье и включил её в список неметаллических простых тел (1789).
В 1822 Э. Мичерлих обнаружил аллотропию С.
е. С. относится к весьма распространённым химич. элементам (кларк 4,7 х
10-2); встречается в свободном состоянии (сера самородная)
и
в виде соединений - сульфидов, полисульфидов, сульфатов (см. Сульфиды
природные, Сульфаты природные, Сульфидные руды). Вода морей и океанов
содержит сульфаты натрия, магния, кальция. Известно более 200 минералов
С., образующихся при эндогенных процессах. В биосфере образуется св. 150
минералов С. (преим. сульфатов); широко распространены процессы окисления
сульфидов до сульфатов, к-рые в свою очередь восстанавливаются до вторичного
H
почв, углях, нефти, морях и океанах (8,9 х 10-2% ), подземных
водах, в озёрах и солончаках. В глинах и сланцах С. в 6 раз больше, чем
в земной коре в целом, в гипсе -в 200 раз, в подземных сульфатных водах
- в десятки раз. В биосфере происходит круговорот С.: она приносится на
материки с атм. осадками и возвращается в океан со стоком. Источником С.
в геологич. прошлом Земли служили гл. обр. продукты извержения вулканов,
содержащие SO
С.- твёрдое кристаллич. вещество, устойчивое в виде двух аллотропических
модификаций. Ромбич. а-S лимонножёлтого цвета, плотность 2,07 г/см3,
t
медово-жёлтого цвета, плотность 1,96 г/см3, t
восьми-членными циклич. молекулами S
в подвижную жёлтую жидкость, к-рая выше 160 °С буреет, а около 190 °С становится
вязкой тёмно-коричневой массой. Выше 190 °С вязкость уменьшается, а при
300 °С С. вновь становится жидко-текучей. Это обусловлено изменением строения
молекул: при 160 °С кольца S
таких цепей.
до 250-300 оС, влить тонкой струёй в холодную воду, то получается
коричнево-жёлтая упругая масса (пластическая С.). Она лишь частично растворяется
в сероуглероде, в осадке остаётся рыхлый порошок. Растворимая в CS
При комнатной темп-ре обе эти модификации превращаются в устойчивую хрупкую
a-S.
t
шкалы). В парах при темп-ре кипения, кроме молекул S
жидким азотом сильно нагретых паров С. получается устойчивая ниже -80 °С
пурпурная модификация, образованная молекулами S
и электричества. В воде она практически нерастворима, хорошо растворяется
в безводном аммиаке, сероуглероде и в ряде орга-нич. растворителей (фенол,
бензол, дихлорэтан и др.).
атома S 3s2 Зр4. В соединениях С. проявляет степени
окисления -2, +4, +6.
легко при нагревании соединяется почти со всеми элементами, за исключением
N
ангидрид и SO
соответственно сернистую кислоту и серную кислоту, а также
их соли сульфиты и сульфаты (см. также Тиокислоты и
Тиосульфаты).
Уже
на холоду S энергично соединяется с F
только S
водорода. С. образует также многосернистые водороды общей формулы H
с металлами, образуя соответствующие сернистые соединения (сульфиды) и
многосернистые металлы (полисульфиды). При темп-ре 800-900 0С
пары С. реагируют с углеродом, образуя сероуглерод CS
получают из серы самородной, а также окислением сернистого водорода и восстановлением
сернистого ангидрида. О способах добычи С. см. Серные руды. Источник
сернистого водорода для произ-ва С.- коксовые, природные газы, газы крекинга
нефти. Разработаны многочисленные методы переработки H
воздуха до С. и частично до SO
боксит или специально изготовляемый алюмогель) происходит реакция: 2H
SO
мире (без социалистических стран) произведено 32,0 млн. т; осн.
масса её добывалась из природных самородных руд. В 70-е гг. 20 в. первостепенное
значение (в связи с открытием крупных месторождений се-роводородсодержащих
топливных газов) приобретают методы получения С. из H
из серных руд С. наз. природной комовой; полученная из Н
при темп-ре выше точки плавления в жидком состоянии и затем разлитая в
формы - черенковой С. При конденсации С. ниже точки плавления на стенках
конденсац. камер образуется мелкий порошок С.- серный цвет. Особо высоко
дисперсная С. носит название коллоидной.
в первую очередь для получения серной кислоты; в бум. пром-сти (для получения
сульфитцеллюлозы); в с. х-ве (для борьбы с болезнями растений, гл. обр.
винограда и хлопчатника); в резиновой пром-сти (вулканизующий агент); в
произ-ве красителей и светящихся составов; для получения чёрного (охотничьего)
пороха; в произ-ве спичек. И. К. Малина.
С. основано на её способности при взаимодействии с органич. веществами
организма образовывать сульфиды и пентатионовую кислоту, от присутствия
к-рых зависят кератолитические (растворяющие - от греч. keras - рог и lytikos
-растворяющий), противомикробные и противопаразитарные эффекты. С. входит
в состав Вилькинсона мази и др. препаратов, применяемых для лечения
чесотки. Очищенную и осаждённую С. употребляют в мазях и присыпках для
лечения нек-рых кожных заболеваний (себорея, псориаз и др.); в порошке
- при глистных инвазиях (энтеробиоз); в растворах - для пиротерапии
прогрессивного
паралича и др.
органич. и неорганич. соединений С. постоянно присутствует во всех живых
организмах и является важным биогенным элементом. Её ср. содержание
в расчёте на сухое вещество составляет: в мор. растениях ок. 1,2%, наземных
- 0,3%, в мор. животных 0,5-2%, наземных -0,5%. Биол. роль С. определяется
тем, что она входит в состав широко распространённых в живой природе соединений:
аминокислот (метионин, цистеин), и следовательно белков и пептидов;
коферментов (кофермент А, липоевая кислота), витаминов (биотип,
тиамин), глутатиона и др. Сульфгидрилъные группы (-SH) остатков
цистеина играют важную роль в структуре и каталитич. активности мн. ферментов.
Образуя дисуль-фидные связи (-S-S-) внутри отдельных полипептидных цепей
и между ними, эти группы участвуют в поддержании пространств/ структуры
молекул белков. У животных С. обнаружена также в виде органич. сульфатов
и сульфокислот -хондроитинсерной кислоты (в хрящах и костях), таурохолиевой
к-ты (в жёлчи), гепарина, таурина. В нек-рых железосодержащих белках
(напр., ферродокси-нах) С. обнаружена в форме кислотолабильного сульфида.
С. способна к образованию богатых энергией связей в мак-роэргических
соединениях.
в организмах высших животных обнаружены в небольших количествах, гл. обр.
в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном
соке, молоке, моче). Мор. организмы богаче неорганич. соединениями С.,
чем пресноводные и наземные. Для растений и мн. микроорганизмов сульфат
(SO
источником минерального питания. Перед включением в органич. соединения
С. претерпевает изменения в валентности и превращается затем в органич.
форму в своём наименее окисленном состоянии; т. о. С. широко участвует
в окислительно-восстановит. реакциях в клетках.
с аденозинтрифосфатом (АТФ), превращаются в активную форму - аденилилсульфат:
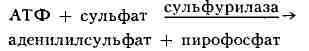
фермент - сульфурилаза (АТФ:сульфат -аденилилтрансфераза) широко распространён
в природе. В такой активированной форме сульфонильная группа подвергается
дальнейшим превращениям -переносится на др. акцептор или восстанавливается.
органич. соединений. Автотрофные организмы получают всю С., содержащуюся
в клетках, из неорганич. соединений, гл. обр. в виде сульфатов. Способностью
к автотрофному усвоению С. обладают высшие растения, мн. водоросли, грибы
и бактерии. (Из культуры бактерий был выделен спец. белок, осуществляющий
перенос сульфата через клеточную мембрану из среды в клетку.) Большую роль
в круговороте С. в природе играют микроорганизмы - десульфурирующие
бактерии и серобактерии. Многие разрабатываемые месторождения
С.- биогенного происхождения. С. входит в состав антибиотиков (пенициллины,
цефалоспорины); её соединения используются в качестве радиозащитных
средств, средств защиты растений. Л. И. Беленький. Лит.: Справочник
сернокислотчика, под ред. К. М. Малина,2 изд., М., 1971; Природная сера,
под ред. М. А. Менковского, М., 1972; Некрасов Б. В., Основы обшей химии,
3 изд., т. 1, М., 1973; Р е м и Г., Курс неорганической химии, пер. с нем.,
т. 1, М., 1972; Я н г Л., М о у Д ж., Метаболизм соединений серы, пер.
с англ., М., 1941; Горизонты биохимии, пер. с англ., М., 1964; Биохимия
растений, пер. с англ., М., 1968, гл. 19; Торчинскпй Ю. М., Сульфгндрильные
и дисульфидные группы белков, М., 1971; Дегли С., Н и к о л ь с о н Д.,
Метаболические пути, пер. с англ., М., 1973.